등록일2013-11-12
NAFLD (비알콜성 지방간) : 전세계적인 문제로 대두되고 있다.
생활습관과 식생활의 급격한 변화로 전세계는 비만과 NAFLD 증가가 가속화 되고 있다.
NAFLD은 간에 지방이 과다 저장되는 광범위한 질환군을 의미하여,
단순 지방간, 비알콜성 지방간염 (NASH), 간경변, 간 섬유화를 유발하여
결국에는 간암에 이를 수 있는 질환이다.
이와 같은 추세라면 바이러스성 간염으로 인해 말기 간질환과 간이식의 발병을 대신하여
다음세대에서는 비만과 NAFLD가 이러한 만성 간질환의 원인이 될 것으로 전문가들은 추측하고 있다. 이미 미국에서는 3명중 1명이, 영국에서는 5명중 1명이 지방간을 가지고 있으며,
소아에서는 더욱 증가하는 경향을 보이고 있다.
한국에서도 비알콜성 지방간의 유병율은 2004년 11.5%에서 2010년 23.6%로 크게 증가하였다.
식약처에서 2013년 1월 발표한 자료에 따르면 기저질환이 없는 성인을 대상으로
탄수화물 섭취량에 따라 3그룹으로 나누어 조사한 자료에서
탄수화물 섭취량이 높은 상위 33% 그룹에서 하위 33% 그룹에 비해
NAFLD 발생율이 남성은 1.7배, 여성은 3.8배가 높은 것으로 나타났다.
이러한 NAFLD 환자를 대상으로 탄수화물 제한 식이 교육을 실시한 결과
전체 환자의 80.0%에서 간염증 수치가 호전되는 것으로 확인되었다.
비알콜성 지방간은 인슐린 저항성이나 대사증후군의 표현형으로 생각되어져 왔으나, 최근 심혈관질환, 당뇨, 고혈압 및 신장질환 발생에 있어 독립적인 인자로 밝혀지면서 그 중요성이 증가하고 있다.
비알콜성 지방간 분류
단순 지방간 (simple steatosis)
지방간염 (NASH, nonalcoholic steatohepatitis)
비알콜성지방간 연관 간경변증
단순 지방간은 심각한 간질환으로 진행이 매우 늦고, 간질환과 연관된 사망률은 높이지 않지만 총사망율을 증가시킨다.
단순 지방간의 경우 15년 - 20년간 1% 정도의 환자에서 간경변으로 진행
지방간염은 간경변 및 간암으로 진행될 수 있고, 간질환과 연관된 사망률과 총사망률을 모두 높인다고 보고되고 있다.
지방간염의 경우 14년간 10%의 환자에서 간경변으로 진행
NFALD 진단
다양한 진단 방법 : 복부 초음파, Magnetic resonance spectroscopy (MR), 간조직검사
간내 섬유화 정도를 예측하기 위한 다양한 방법 중
최근 학계에서는 NAFLD fibrosis score를 권고하고 있다.
NAFLD fibrsosis score는 임상적으로 쉽게 측정할 수 있는 6개의 지표
(연령, BMI, 공복혈당, 혈소판, 알부민, AST/ALT ratio)를 활용하여 인터넷을 통해 쉽게 계산할 수 있으며, 기존의 다른 예측 모델과 비교하여 예측 능력도 우수한 것으로 알려져 있다.
알콜성 지방간과 비알콜성 지방간의 구분
(ALD vs NAFLD)
- 섭취하는 알콜의 양이 중요한 구분 기준
- 2012년 미국 간질환연구호와 미국소화기학회, 미국소화기관련학회가 공동으로 발표한 진료지침에 의하면 최근 2년간 일주일에 남자는 210g, 여자는 140g을 초과하는 경우로 정의
11월 발간된 Nature Reviews Gastroenterology #amp; Hepatology 저널에서 비알콜성 지방간 (NAFLD) 특집판을 발간하여 최근 급증하는 NAFLD의 심각성을 다시 한번 일깨워 주고 있다.
분야별 전문가 발표한 8개의 논문을 통해 NAFLD의 유병율에서 부터 유전적인 문제점, 질병의 기전, 진단, 치료방법, 말기 간질환으로 진행 등에 대해 자세히 설명하고 있다.
NAFLD의 발생 기전
비알콜성 지방간은 유전적인 요인과 환경요소, 특히 식습관, 장내 세균의 상호작용으로 발생한다.
NAFLD 형성에 영향을 미치는 식사와 유전적인 요인
PUFAs (polyunsaturated fatty acid)는 지방간과 지방간염과 관련이 있다.
n3 PUFAs (a-linolenic acid)는 항염증 효과를 나타내는 반면
n6 PUFAs (linoleic acid)는 염증성 eicosanoids의 중요한 전구체로 작용한다.
식품 감미제의 주요 성분인 Fructose는 특히 지방간의 주요 원인으로 주목받고 있다.
유전적인 요인과 환경, 장내 세균총의 상호작용으로 NAFLD의 표현형, 질병의 진행, 만성화 여부가 결정된다.

NLRP3 inflammazome 활성 기전
인플라마좀은 NLRP3, NLPR1, ASC, caspase1과 같은 단백질 복합체이며,
간세포의 쿠퍼세포에서 발현된다.
인플라마좀은 두가지 신호 전달 체계로 활성화된다.
Signal 1(점선)은 TLR와 IL1R에 의해 시작되며 NLRP3, ASC, pro-caspase1, pro-IL1β, pro-IL18 발현을 유도한다.
Signal 2는 PAMPs 혹은 DAMPs에 의해 유도되며 인플라마좀의 oligomerization을 형성하여 IL-1β, IL18과 같은 염증 사이토카인들을 분비시키는 caspase-1을 분리시킨다.
(DAMP, damage-associated molecular pattern; PAMP, pathogen-associated molecular pattern; TLR, Toll-like receptor
NLRP3는 활성화되었을 때에 인플라마좀(inflammasome)이라는 단백질 복합체를 형성시킨다. 인플라마좀은 여러 병원체의 공격에 대응하여 다중 면역 경로에 관여하는 것으로 알려져 있다.)
염증과 면역반응이 만성화된 NAFLD의 진행과 관련된다는 사실은 새로운 시각을 제시한다.
간에서 과다 지방을 처리하는 방법과 이렇게 축적되는 다양한 지질의 종류와 대사체 들은 간 대사의 균형을 손상시키는 중요한 요소들이라는 사실이 밝혀지고 있다.
비만과 NAFLD의 중요한 원인 : 장내 세균 불균형 (Dysbiosis of Microbiota)
비만과 NAFLD의 원인 : 장내 세균 불균형
장내세균총은 나이, 식이, 항생제 사용, 담즙산, 염증 등 많은 원인에 의해 영향을 받게 된다.
또한 장내 세균총과 비만, NAFLD는 상호 영향을 주고 받고 있다.
이러한 영향은 영양소, 염증매개물질, 호르몬과 같은 생물학적인 중간체에 의해 일어난다.
비만과 NAFLD에 영향을 미치는 인플라마좀
비만과 NAFLD에 영향을 미치는 인플라마좀
a : 정상상태 : 인플라마마좀은 tissue homeostasis와 장내세균의 조성 등을 포함하여 다양한 과정을 조절한다. IL18은 이 과정에서 중요한 역할을 담당하는 것으로 알려져 있으며, 장내세균과 정확한 상호작용은 밝혀지지 않았다.
b : 인플라마좀 기능이 결핍된 경우, Prevotellaceae, TM7, Porphyromonadaceae (보라색으로 표시)와 같은 혐기성 균이 증가. 이러한 불균형 (Dysbiosis)는 간 문맥에서 TLR4와 TLR9 리간드를 증가시키고 이로 인해 비만과 NAFLD가 발생한다.
c : 정상쥐와 인플라마좀 결핍 쥐를 같이 사육하는 경우 dysbiosis가 나타나고 간문맥에서 TLR 리간드가 증가한다. 인플라마좀 결핍쥐를 제거하면 wild-type mice는 정상으로 바뀌게 된다.
장내세균총은 장관내에서 국소적인 작용을 넘어서 비만과 NAFLD와 같이 전신적 변화를 일으킬 수 있다는 측면에서 그 중요성이 부각되고 있다. 장내세균총은 식이, 담즙산, 장관내피세포, 약물와 다양하게 상호작용을 일으킨다.
장내 세균의 조성에 따라, 또한 박테리오파지와 세균의 조성에 의해서도 이러한 다양한 조절작용이 나타나고 있다. 그러므로 다양한 상호작용을 모두 이해하여 치료에 적용하는 것은 어려운 일이다.
그렇지만 장내 세균총의 불균형을 바로잡는 probiotic 투여는 가능한 시도라고 생각된다.
특히 TLR4와 TLR9의 작용을 규명한 것은 다양한 기관에서 손상을 감소시키기 위한 목적으로 TLR 억제제를 개발하는 출발점이 되고 있다.
NAFLD 진단 알고리듬
(HCC, hepatocellular carcinoma; NFS, NAFLD fibrosis score; NPV, negative predictive value; PPV, positive predictive value.)
NAFLD 비침습적 진단을 알고리듬
NAFLD fibrosis score는 NAFLD의 진행과 , 섬유화 정도, 조직생검을 결정하기 위한 중요한 지표이다.
초음파로 간의 탄성율을 측정하는 Transient elastography는 FDA의 승인을 받았으며, 널리 이용되므로 알고리듬에 포함시켰다. 이 알고리듬은 간단하고 임상에서 적용하기가 쉬운 반면 잘 설계된 임상시험을 실시하여 검증이 필요하다.
지방간의 정도, NASH 진단, 간섬유화 단계를 포함하여 NAFLD를 평가하기 위한 비침습적 방법은 지난 수년간 많은 논의가 진행되어 왔다.
NAFLD 유병율이 급격하게 증가하면서 이러한 비침습적 진단 방법은 임상에서 NAFLD 환자를 확인하는데 유용하게 사용된다.
혈장 바이오마커나 간의 경화정도는 바이러스성 간염이나 알콜성 간질환과 같은 만성 간질환 환자에게는 유용한 방법이다.
NAFLD fibrosis score 시스템은 NAFLD 환자중 간질환과 관련된 질환, 사망, 간이식과 같은 중증질환의 고위험군을 판별하기에 적절하다.
이 알고리듬은 간조직 생검이 필요한 환자를 판별하기 위해 사용할 수 있다.
NAFLD에서 간암으로 진행
비알콜성 지방간염 (NASH) 환자는 14년간 약 10% 정도가 간경변으로 진행된다.
최근 전세계적으로 급증하는 간세포암 (HCC)는 비만이나 NAFLD 증가가 원인이라고 밝혀지고 있다.
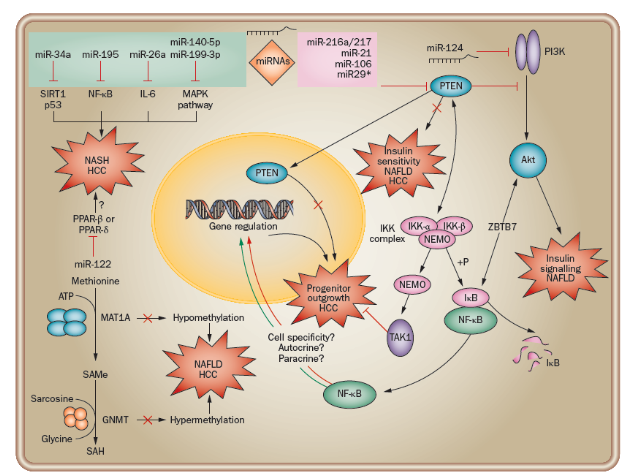
NAFLD에 의한 암발생 pathway
암을 유발하는 MicroRNA (miRNA)는 분홍색 상자, 암을 억제하는 miRNA는 초록색 상자로 표시함.
miR29는 대표적인 암 억제 RNA에 속한다.
(GNMT, glycine Nmethyltransferase; HCC, hepatocellular carcinoma; IκB, inhibitor of NFκB; IKK, IκB kinase; MAT, methionine adenosyltransferase; NEMO, NFκB essential modifier; NFκB, nuclear factor κB; P, phosphorylation; PPAR, peroxisome proliferator-activated receptor, SAH, Sadenosyll-homocysteine; SAMe, Sadenosylmethionine. )
NAFLD는 전세계적으로 확산되고 있으며, 비만과 당뇨도 NAFLD과 연관되어 증가하고 있다. 이로 인하여 간암 특히 간세포암의 위험도 증가하고 있다.
비록 NAFLD가 간세포암으로 발전하는 동물시험 모델이 이제 시작되고 있지만, 공중 보건을 위협하는 이 사태를 치료하고, 진단하고, 에방하기 위해서는 추가적인 연구가 절실히 필요하다.
NAFLD : 다양한 유전적 변이
대규모 유전자 분석 연구에서 확인된 유전적 변이는 놀랍게도 거의 일치하는 부분이 없었다.
위의 그림은 가장 대규모 연구가 세가지를 각각 다른 색으로 표시하였으며, 제1저자의 이름으로 구분하였다. PNPLA3 (patatin-like phospholipase domaincontaining protein 3) 유전자 1개만이 세가지 연구에서 중복되는 것으로 나타났다.
(ALT, alanine aminotransferase; CPN1, carboxypeptidase N catalytic chain; GWAS, genome-wide association studies; HSD17B13, 17-beta-hydroxysteroid dehydrogenase 13; GCKR, glucokinase regulatory protein; LYPLAL1, lysophospholipase-like protein 1; NCAN, neurocan core protein; PPP1R3B, protein phosphatase 1 regulatory subunit 3B; PNPLA3, patatin-like phospholipase domaincontaining protein 3; TRIB1, tribbles homologue 1)
NAFLD는 질병의 표현형과 진행정도, 환경인자, 유전적 다양성 등이 복잡하게 작용하는 질병으로 알려져 있다.
대규모 유전자 분석 연구를 통해 NAFLD의 유전적 변이를 확인하려는 시도가 이루어 졌으며 현재까지는 PNPLA3 유전자 만이 NAFLD와 관련이 있는 것으로 확인되었다.
NAFLD 치료
1) 생활습관 교정 : 체중감량
비알콜성 지방간 치료의 가장 중요한 부분은 체중감량이다.
3-5%의 체중 감소는 간내 지방 감소를 유발할 수 있으며,
지방간염환자 (NASH)에서 간내 염증을 호전시키려면 최소 10% 이상의 체중감량이 필요하다.
식이요법으로는 총 에너지 섭취량 감소가 가장 중요하며 약 25% 정도 감소를 권고한다.
특히 한국인의 경우는 탄수화물 위주의 식단이 NAFLD를 증가시키므로 저탄수화물 식사를 하는 것이 바람직하다.
그러나 이러한 운동요법은 간내 지방은 감소시키지만 간내 염증 및 섬유화를 개선시키는 지는 명확하지 않다.
2) 약물 치료
현재까지 비알콜성 지방간염 (NASH) 치료 효과 입증된 약물로는 항산화제인 비타민E (800 IU/day)를 1차 약물로 권고하고 있다. 당뇨를 동반하지 않은 지방간염 환자에서 조직 개선이 확인되었다.
인슐린 저항성 개선제인 피오글리타존도 지방간염 환자에서 ALT 수치를 호전시키고 간내 지방 침착 및 염증 소견을 개선시키는 효과가 보고되었지만 적절한 투여기간이나 치료용량, 장기간 치료시 부작용 등이 아직 명확하게 확인되지 않아 조직검사로 지방간염이 확인된 경우에만 사용하도록 권고하고 있다.
그동안 사용되어 왔던 메트포르민, 스타틴, 오메가-3등은 지방간염 치료약물로는 추천되지 않는다.
다만 고지혈증이 있는 단순 지방간에는 스타틴 사용이 가능하다고 언급하고 있다.
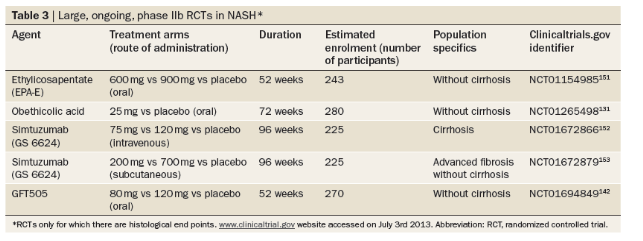
NASH 치료 약물 개발은 이제 시작되고 있으며, 현재 진행되고 있는 대규모 연구를 아래 표에 정리하였다.
비만과 NAFLD 전세계 유병율
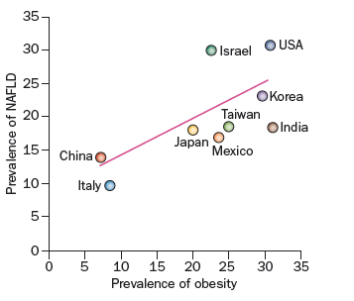
Figure 1 | The prevalence of NAFLD plotted as a function of the prevalence of obesity in various countries around the world.
NAFLD 증가는 전세계적인 현상이며, 한국에서도 유병율이 급격하게 증가하고 있어 사회적인 문제로 떠오르고 있다.
사회적인 수준에서 NAFLD의 문제점을 더욱 잘 인지하고 다음 세대의 건강을 위해 새로운 대응책을 마련해야 할 것이다.
근거]
1. NAFLD-the next global epidemic.
Ray K.
Nat Rev Gastroenterol Hepatol. 2013 Nov; 10(11) : 621.
2. The global NAFLD epidemic.
Loomba R, Sanyal AJ.
Nat Rev Gastroenterol Hepatol. 2013 Nov; 10(11) : 686-90.
3. NAFLD, NASH and liver cancer.
Michelotti GA, Machado MV, Diehl AM.
Nat Rev Gastroenterol Hepatol. 2013 Nov; 10(11) : 656-65.
4. From NAFLD to NASH to cirrhosis?new insights into disease mechanisms
Alexander Wree, Lori Broderick, Ali Canbay, Hal M. Hoffman #amp; Ariel E. Feldstein.
Nat Rev Gastroenterol Hepatol. 2013 Nov; 10(11) : 627-636
5. The Gordian Knot of dysbiosis, obesity and NAFLD
Wajahat Z. Mehal.
Nat Rev Gastroenterol Hepatol. 2013 Nov; 10(11) : 637-644
6. The genetics of NAFLD
Quentin M. Anstee #amp; Christopher P. Day.
Nat Rev Gastroenterol Hepatol. 2013 Nov; 10(11) : 645-655
7. Noninvasive evaluation of NAFLD
Laurent Castera, Valerie Vilgrain #amp; Paul Angulo.
Nat Rev Gastroenterol Hepatol. 2013 Nov ; 10(11) : 666-675
8. Pharmacological agents for NASH
Vlad Ratziu.
Nature Reviews Gastroenterology and Hepatology 10, 676-685