등록일2016-02-03
안구건조증 치료제 Lifitegrast FDA 재신청
샤이어(Shire)가 개발중인 안구건조증 치료제 Lifitegrast가 의약품 허가를 위해 다시 한번 FDA 문을 두드렸다. 샤이어는 지난해 10월 FDA로부터 Lifitegrast의 효과 입증을 위한 임상 데이터가 부족하다는 이유로 의약품 승인을 거절 받은 바 있다. OPUS-3 임상 3상 결과를 추가하여 2016년 1월 25일 다시 FDA 승인을 위한 재도전에 나섰다.
안구건조증 이란?
안구건조증은 다양한 원인에 의해 1)눈물 생성의 감소, 2)눈물 증발에 따른 눈물막의 소실에 따른 안구의 이물감이나 따가움이 주된 증상인 안구 표면 질환이다. 최근에는 눈물막의 삼투압(hyperosmolarity) 증가와 안구 표면의 염증에 의해 눈물막이 파괴되고 안구 표면이 손상되어 발생하는 다인성 안구 질환으로 이해되고 있다(DEWS 2007).
최근 과도한 컴퓨터 사용, 냉난방 기구 사용 등 건조해진 생활환경 등의 이유로 안구건조증 발생률이 점점 증가하고 있는 추세로서 미국의 경우 2,900만명의 많은 환자가 있다.
안구건조증 주요 증상은 안구건조, 눈시림, 이물감, 통증, 충혈 등이다.
대표적인 진단 방법은 형광염색약으로 각막을 염색한 후 세극등 검사를 통해 각결막의 건조와 상처 정도를 진단하거나, 쉬르머 검사를 통해 눈물 분비량을 측정하기도 한다.
[그림 1] 안구건조증 증상 및 진단
안구건조증은 질환 정도에 따라 4단계로 구분되며 각 단계에 따라 치료 방법은 달라지게 된다 (그림 2). 증상이 심하지 않은 level 1, level 2 의 환자가 전체 환자수의 70% 이상을 차지하는데 level 1은 특별한 치료 없이 인공누액 투여만 하게 되고 level 2의 환자는 주로 anti-inflammatory therapy (대표적으로 topical cyclosporine A)로 치료하게 된다.
A. 안구건조증 증상 심각도에 따른 분류
B. 환자 분포
C. 증상 심각도에 따른 치료 방법
(Korean J Ophthalmol 2014;28(3):197-206)
Lifitegrast
Lifitegrast는 leukocyte의 세포 표면에 존재하는 integrin lymphocyte function-associated antigen-1 (LFA-1)에 결합하여 LFA-1과 intercellular adhesion molecule-1 (ICAM-1)의 결합을 방해하는 작용을 한다. ICAM-1은 안구 건조질환에서 각막과 결막 조직에서 과발현되는 것으로 알려져 있다.
LFA-1이 ICAM-1에 결합하면 T 세포를 활성화시키고 타겟 조직으로 이동시키는 immunological synapse 역할을 한다. 실험 결과에 의하면 lifitegrast는 ICAM-1 발현 세포에 T 세포가 결합하는 것을 막고 주요 염증 사이토카인 (IFNγ, TNFα, IL-2)의 분비를 억제하는 것으로 확인되었다.
Lifitegrast 임상
Lifitegrast는 안구건조증 환자 2,570명을 대상으로 임상 2상 1건, 임상 3상 4건의 총 5건을 7년에 걸쳐 수행하였다 (그림 4)
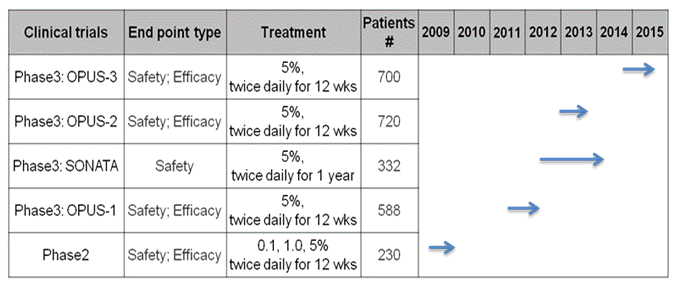
[그림 4] Lifitegrast 임상 현황
첫번째 임상 3상인 OPUS-1에서는 5% Lifitegrast를 12주 동안 하루 2회 점안하고 safety와 efficacy를 확인하였다. 1차 객관적 평가변수는 fluorescein으로 염색한 후 아래쪽 각막(inferior cornea)에서 scoring 한 것을 사용하였고, 1차 주관적 평가변수는 여러 증상의 문진 결과를 scoring 하는 Ocular Surface Disease Index (OSDI)를 적용하였다. 그 결과 그림 5에서와 같이 각막 염색에 의한 효과 확인에서는 Placebo 대비 유의적으로 질환 개선 효과가 있었으나 OSDI는 유의적 차이가 없었다. 그러나 증상 중에서 안구 불편감과 건조함에 대한 것은 효과가 있는 것으로 나타났다.
[그림 5] OPUS-1 Phase 3 결과
OPUS-2 임상3상은 좀더 대규모로 718명의 환자를 대상으로 실시하였다. 여기서는 이전 임상에서 endpoint를 맞추지 못한 주관적 1차 평가 변수를 VS-OSDI에서 안구 건조만 확인하는 Eye Dryness Score (EDS)로 변경하여 진행하였다. 그러나 OPUS-1에서와 달리 각막 염색에서의 효과가 placebo 투여군 대비 유의적이지 않았고 눈의 건조함에 대한 효과는 동일하게 확인되었다.
[그림 5] OPUS-2 Phase 3 결과
SONATA 임상은 일년동안 장기간 투여하면서 약물의 safety를 확인하는 임상이다. 총 331명의 환자를 대상으로 하였는데 심각한 adverse effect는 나타나지 않았으나 Lifitegrast 투여 환자의 경우 Placebo 투여군 보다 adverse events가 많이 나타났고 거의 50% 정도의 환자에서 미각장애, 안구자극 등이 확인되었다.
금번에 FDA 승인을 위해 추가 자료로 제출된 OPUS-3 임상은 711명의 환자를 대상으로 대규모로 이루어졌고 2015년 10월에 완료되었다. 앞선 OPUS 임상과 마찬가지로 12주 동안 1일 2회 투여하였다. 기존 임상과 다른 점은 1차 평가 변수를 subjective dryness score 한가지로만 정해서 평가했다는 것이다. 아마도 지난 임상에서 확실한 효과를 나타낸 평가 항목인 dryness score를 1차 평가 변수로 해서 임상 실패 가능성을 낮추고자 했던 것으로 보인다. 결과적으로 OPUS-3 임상은 Placebo 대비 유의적 효과를 입증하는데 성공했다고 2015년 10월 발표되었다.
샤이어는 Lifitegrast 안구건조증 임상을 임상2상부터 3상까지 2500명 이상의 환자를 대상으로 7년에 걸쳐 진행하였고 마지막 임상 OPUS-3 결과를 추가한 허가자료를 2016년 1월 25일 FDA에 제출하였으며 그 심사 결과를 기다리고 있다. 현재 전 세계적으로 안구건조증에 가장 많이 사용되고 있는 (2014년 매출 10.8억불) 알러간의 Restasis에 뒤를 이을 anti-inflammatory drug으로 Lifitegrast가 자리잡을 수 있을지 귀추가 주목된다.
[근거]
1. Thomsonreuters Database
https://cortellis.thomsonreuterslifesciences.com
2. Ophthalmology Volume 121, Number 2, February 2014
3. Ophthalmology Volume 122, Number 12, December 2015