등록일2015-07-22
면역항암제 옵디보, 폐암 치료 우수성 입증
암에 대한 면역 반응을 증가시켜 암을 치료할 수 있게 하는 면역항암제가 암 치료의 획기적인 전략으로 떠오르고 있다. 일반적으로 면역 반응은 비정상적인 세포를 제거하는 역할을 하는데 암세포는 자신에 대한 면역 반응을 막는 메커니즘을 작동시켜 생존 전략으로 사용하고 있다.
면역항암제는 면역시스템이 암세포에 대해 효과적으로 작용할 수 있도록 강화시키는 새로운 분야의 약으로서 지난 30년 이상의 연구 기간을 거쳐 그 약효가 입증되었고 최근 시장에 출시되기 시작하였다. 제약 분야 시장조사기관인 이벨류에이트파마는 2020년 세계 면역치료제 시장 규모가 약 350억 달러(약 39조 5500억원)에 이를 것으로 예상하고 있을 정도로 성장이 기대된다.
면역항암제 중에서 선두 그룹은 checkpoint 저해제 항체 제품인 CTLA-4에 대한 여보이(Yervoy, BMS사), PD-1의 키트루다(Keytruda, MSD사)와 옵디보(Opdivo, BMS사) 인데 세 제품 모두 흑색종(melanoma) 적응증으로 미국 FDA 판매 승인을 받았고 다양한 암에서 임상을 실시하고 있다.
|
제품명 |
물질명 |
적응증 |
개발 단계 |
|
Yervoy |
ipilimumab |
Melanoma |
승인 (2011.03) |
|
Prostate cancer |
임상 3상 | ||
|
Keytruda |
pembrolizumab |
Melanoma |
승인 (2014.09) |
|
NSCLC |
허가 진행중 | ||
|
Head #amp; neck cancer |
임상 3상 | ||
|
Opdivo |
nivolumab |
Melanoma |
승인 (2014.09) |
|
NSCLC |
승인 (2015.03) | ||
|
Head #amp; neck cancer |
임상 3상 |
옵디보는 편평세포성 비소세포폐암에서 다른 제품들에 비해 제일 먼저 임상에서의 우수성을 입증하고 올해 3월 미국에서, 7월 유럽에서 허가를 획득하였다. Docetaxel과 단독 비교 임상 3상인 CheckMate 017의 결과가 NEJM 2015년 7월 9일에 발표되었고 우수한 효과와 안전성의 결과를 보여 주고 있다.
편평세포암은 비세포성 폐암(NSCLS) 중 약 30%에 달하는 암으로 1999년에 2nd line treatment 로서 docetaxel이 허가된 이후로 마땅한 치료제 개발이 안되어 unmet need가 매우 큰 질환이다. PD-1 항체는 지난해 말 승인된 흑색종(melanoma)에 이어 지난해 말 허가되었고 연이어 NSCLC를 적응증으로 하는 임상 3상이 진행되어 옵디보는 판매 승인을 받았고, 키트루다는 허가가 진행 중이어서 적절한 치료제가 없는 이 적응증 분야에서 큰 기대가 되고 있다.
옵디보(Obdivo, nivolumab)의 임상 3상
CheckMate-017(docetaxel 대조 투여, 임상 3상)에서는 135명의 3기 또는 4기 편평세포성 비소세포폐암 환자에게 옵디보를 격주 3mg/kg으로 정맥투여하였고, 137명 환자에게는 docetaxel을 3주마다 75mg/m2의 용량으로 정맥투여하였다.
주 평가변수(primary endpoint)는 전체 생존(overall survival) 이었으며, 부수적인 평가변수는 무진행 생존(progression-free survival), 환자보고성과(patient-reported outcomes), PD-L1 발현율에 따른 효과, 안전성(safety)을 관찰하였다. 임상약은 질환의 진행이 나타나거나 독성으로 인해 중단될 때까지 투여하였고 투여가 종료된 후 최소 11개월 동안 follow-up 하였다.
임상3상 Efficacy
옵디보 투여군의 전체 생존 중앙값(median overall survival)은 9.2개월로 docetaxel 6.0개월 대비 3.2개월이나 증가한 결과를 나타냈다. 전체 생존은 옵디보가 docetaxel 대비 유의적인 증가를 보여주었으며 사망률도 41%나 낮은 결과를 나타냈다. 1년 후 전체 생존율은 옵디보가 42%, docetaxel은 24% 였다.
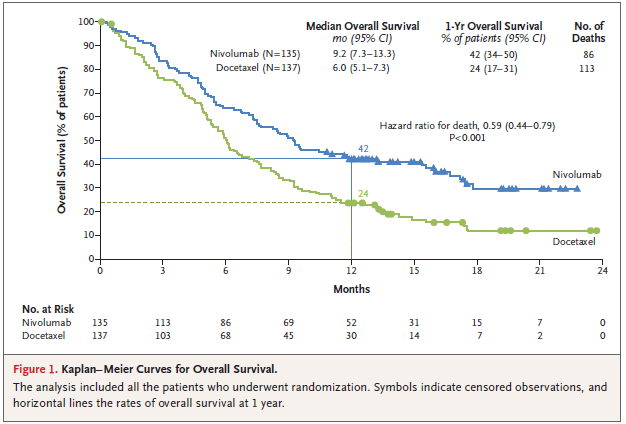
[그림 1] 전체 생존에 대한 Kaplan-Meier 곡선
고형암에 대한 Response Evaluation Criteria에 따른 객관적 반응률도 docetaxel 대비 옵디보에서 더 높았다(20% vs. 9%) (표 2).
[표 2] 옵티보(nivolumab)과 docetaxel 투여시 편평세포성 비세포폐암 환자의 임상적 활성
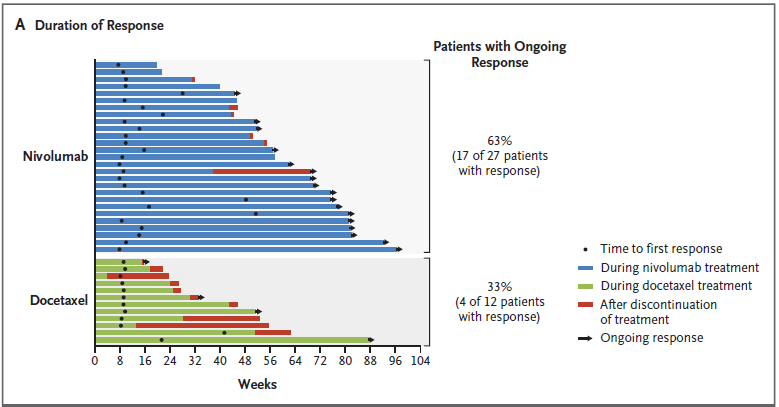
반응 시간(time of response)은 2.2개월로 docetaxel 2.1개월과 유사하였고, 반응 기간(duration of response)은 옵디바는 2.9개월 ~ 20.5+개월, docetaxel은 1.4+개월 ~ 15.2+개월 (+: ongoing response)을 나타냈다 (그림 2A).
평균 무진행 생존(median progression-free survival)은 3.5개월로 docetaxel 2.8개월에 비해 더 길었다. 1년 무진행 생존율(rate of progression survival)은 21% vs. 6%로 뚜렷한 좋은 효과를 나타냈다 (그림 2B).
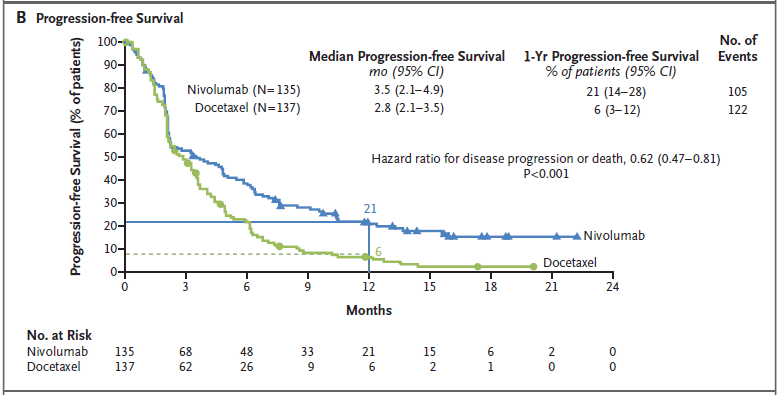
[그림 2B] Progression-free survival에 대한 Kaplan-Meier 곡선
임상 환자 275명 중 83%인 225명에 대해 PD-1 리간드인 PD-L1 발현을 측정하였다. PD-L1 발현은 암 조직을 면역화학염색하여 발현 정도를 측정하는 방법을 사용하였다. PD-L1 발현은 두 그룹간에 유사하였고 세포표면에 발현 정도와 효과와 상관관계는 관찰되지 않았다 (그림 2C).
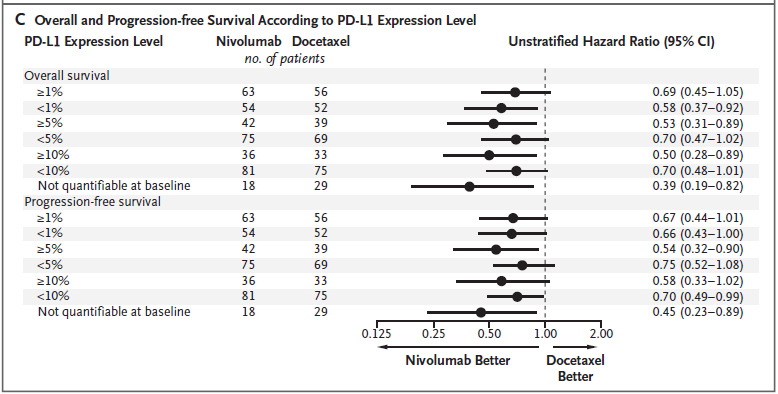
[그림 2C] PD-L1 발현율에 따른 사망(overall survival 분석)과 사망 또는 질환 진행(progression-free survival 분석)에 대한 위험율
임상3상 safety
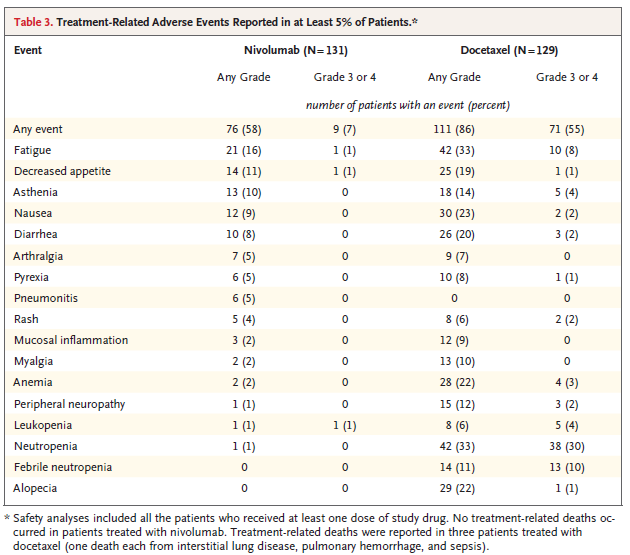
투여와 관련된 부작용은 docetaxel에 비해 옵디보 투여군에서 훨씬 적은 수로 발생되었다. 옵디보 투여 환자 58%가 부작용을 나타냈는데 그 중 grade 3, 4는 7% 였고, grade 5의 심각한 부작용은 없었다. Docetaxel 투여군은 86%에서 부작용을 나타냈으며 이중 55%가 grade 3, 4에 해당하였고, grade 5는 2% 환자에서 나타났다 (표 3).
옵디보 투여군의 가장 빈번한 부작용은 피로(16%), 식욕감퇴(11%), 무기력(10%) 였고 docetaxel 투여시는 백혈구감소증(33%), 피로(33%), 탈모(22%), 메스꺼움(23%) 이었다. 옵티보 투여 환자 중 발생한 심각한 부작용 중 grade 3은 3건이 보고되었는데 tubulointerstitial nephritis, colitis, and pneumonitis 였고 grade 4는 없었다. (논문참조) 그리고 심각한 부작용으로 투여를 중단한 경우는 docetaxel 투여군에 비해 옵티보 투여군이 적었다 (10% vs 3%)
암세포에 의한 몸의 면역 기능 저하를 막아 면역시스템이 암세포를 공격하도록 하는 면역항암제는 암의 근본적 치료에 중요한 전환점을 가져올 것으로 예상된다. 흑색종, 폐암을 선두로 하여 다른 암 종류의 치료에 차례로 그 영역을 넓혀 나갈 것으로 예상되며 향후 암치료법에 큰 변화를 가져올 것으로 보인다.
[근거]
1. NEJM, July 9, 2015, 373;2 : 123-135
Nivolumab versus Docetaxel in advcanced squamous-cell non-small cell lung cancer
2. Datamonitor DMKC0139837 21/05/2015
Immuno-oncology: Pipeline