등록일2014-12-05
헬리코박터균에 의한 위장질환의
새로운 치료제 LipoLLA

헬리코박터 파일로리균 (H. Pylori)에 의한 위장질환은 항생제 남용으로 인하여 항생제 내성이 생겨 기존 항생제로는 치료가 점점 어려워지고 있다.
그런데 최근 미국 샌디에이고 캘리포니아대학 의과대학 암센터 연구팀은 나노 피막입자인 리포솜에 식물성기름인 Linoleic acid (LLA)를 넣어 새로운 헬리코박터 치료제 LipoLLA를 개발했다고 미국국립과학원 회보(Proceeding of National Academy of Sciences) 온라인판에 발표됐다. 연구팀이 개발한 LipoLLA는 항균작용을 위해 박테리아의 세포막에 결합 한 뒤 Linoleic acid (LLA) 분자를 쏟아내 박테리아를 사멸시키게 된다 (그림 1).

[그림 1. Schematic illustration of LipoLLA fusing with bacterial membrane for antibacterial activity]
Linoleic acid (LLA)는 양쪽성 특성 때문에 리포솜 안으로 쉽게 로드(load) 될 수 있다.
쥐의 위에서의 LipoLLA 머무름과 분포

[그림 2. Retention and distribution of LipoLLA in mouse stomach. (A) Anatomic illustration of stomach lining infected by H. pylori. (B-D) Fluorescence images of LipoLLA from the luminal lining of freshly excised mouse stomach at 0 (untreated), 4, and 24 h after oral gavage of LipoLLA, respectively. (E) Quantification of LipoLLA retained in the mouse stomach 4 and 24 h afteroral gavage. (F-H) Bright-field, fluorescence, and overlay images of a transversecryosection of a mouse stomach collected 4 h after the oral gavage ofLipoLLA. All images are representative of n = 3 mice, and the retention is quantified as the mass of LipoLLA per stomach ± SD (n = 5). (Scale bars, 5 mminB-D and 1 mm in F-H.]
헬리코박터 파일로리균 (H. Pylori)은 주로 상피조직에 가까운 점막성의 진액(mucus)층에 존재한다. 따라서 효과적인 항균 처방을 위해서는 진액 층에서의 LipoLLA 삼투와 위 막에서의 머무름이 중요하다 (그림2A).
쥐의 위에서 LipoLLA의 머무름과 분포를 알아보기 위해 형광표지가 달린 LipoLLA를 쥐에게 경구 투여하였다. 투여한지 4시간과 24시간 후에 쥐의 위를 절개하여 형광이미지를 확인한 결과 대조군인 LipoLLA를 투여하지 않은 쥐의 위 조직에서는 형광물질이 검출되지 않았다 (그림2B). 반면에 경구투여 4시간 (쥐의 위 소화시간 보다 긴 시간) 후에 채취한 위 조직에서는 강한 형광발광이 관측되었다 (그림 2C). 따라서 여기서 분명하게 관측된 리포솜의 존재는 위 내벽에서의 리포솜의 머무름을 암시하는 것이다.
약물 투여 후 24시간 뒤의 형광 이미지 또한 비록 그 세기는 줄어들었지만 위 전체에 걸쳐 형광물질이 존재함을 보여주고 있다 (그림 2D).
정량적으로 LipoLLA는 투여 후 4 시간 뒤 위에 69μg이 남아 있었다. 이 양은 이후 24 시간 뒤에는 34μg으로 줄어들었다 (그림 2E).
더 나아가 연구진은 약물 투여 후 4 시간 뒤 쥐의 위를 가로로 잘라
(cryosection;의학기술) LipoLLA의 조직 분포를 조사하였다. 현미경을 통해 위의 기관 내 쪽에서 얇은 막의 점액을 볼 수 있었다 (그림 2F).
같은 샘플로부터 얻어진 형광 이미지는 cryosection의 내벽에 있는 고른 분포의 얇은 LipoLLA 막을 보여준다. (그림 2G) 형광 이미지와 현미경 이미지의 공통된 결과를 통해 위 상피조직 쪽으로 LipoLLA가 포진하면서 그 자리에 머물러 있는 것으로 확인됐다 (그림 2H).
생체 내의 Anti-H. pylori 효험
생체 내에서H. pylori균에 대한 LipoLLA의 치료 효험을 평가하고자 H. pylori 감염 모델을 설정하기 위해 C57BL/6 쥐에 3 x 108 CFU 의 헬리코박터 파일로균(H. Pylory) 를 이틀 간격으로 3번 경구 투여시켜 감염시켰다 (그림 3A). 균 접종 2주 후에 감염 시킨 쥐는 다섯 그룹으로 나뉘어 각각 PBS, Bare 리포솜, 삼제요법 (항생제), Linoleic acid (LLA), LipoLLA로 치료하였다. 위산을 중화시키고 잠재적인 약물 분해를 막기 위하여 위의 모든 제제를 투여하기에 앞서 모든 쥐에게 30분간 양성자펌프억제제를 투여하였다. 이 연구에서 LipoLLA의 치료 효험은 쥐 위의 H. pylori 수를 비교하여 평가하였다.
각 (제제로) 치료 후 PBS와 Bare 리포솜으로 치료한 두 양성 대조군의 쥐 위의 H. pylori 수는각각 1.6 x 108 과 1.0 x 108 CFU/g 존재함을 나타내었다 (그림 3B). 음성대조군인 삼제요법 항생제 치료를 한 쥐에서는 7.2 x 105 CFU/g의 H. pylori이 관찰되었으며 이는 음성 대조군과 비교했을 때 H. pylori 수가 상당히 감소되었다. DMSO에 미리 용해시킨 Linoleic acid (LLA)로 치료한 쥐의 H. pylori 수는7.5 x 106CFU/g 정량 되었다. 두 양성 대조군과 비교하여 Linoleic acid (LLA)로 치료한 쥐에서의 미미한 박테리아수 감소는 H. Pylori 감염에 있어서 Linoleic acid (LLA)는 효과가 없음을 시사한다.
이와 대조적으로 LipoLLA로 치료한 경우 H. pylori 수는 5.5 x 104 CFU/g으로써 다른 그룹과 비교하여 현저한 감소를 보였다. 특히 LipoLLA로 치료한 경우H. Pylori 수 및 염증표지가가 항생제 투여했을 때보다 10배 이상 줄어들었다.

[그림 3. Anti-H.pyloriefficacy in vivo. (A) The study protocol including H. pylori inoculation and infection development in C57BL/6 mice, followed by the treatments. (B) Quantification of bacterial burden in the stomach of H. pylori-infected mice treated with PBS, bare liposome, triple therapy, LLA, and LipoLLA, respectively (n = 8 per group). Bars represent median values.*P <0.05, **P <0.001.]
LipoLLA 치료에서의 염증반응
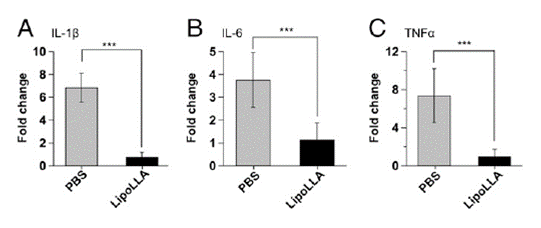
생체 내 LipoLLA의 독성 평가
감염되지 않은 쥐를 가지고 LipoLLA의 독성을 평가하였다. 이 실험에서 PBS 버퍼나 LipoLLA를 5일 연속으로 하루에 한 번 쥐들에게 경구 투여했다. LipoLLA를 투여 받은 쥐들은 PBS를 투여 받은 쥐들과 같은 체중을 유지했다 (그림 5A). 5일 동안 모든 쥐들은 특별할 만한 체중 변화를 보이지 않았다. 여섯째 날 모든 쥐들로 부터 세로로 자른 위 조직을 수거하여 헤마톡실린과에오신에 넣어 보관하였다.
LipoLLA를 투여 받은 위 조직은 PBS를 투여 받은 샘플로부터의 위 조직과 같이 퍼지지 않은 깨끗한 상피 세포를 유지했다 (그림5B and C). LipoLLA의 독성은 위 점막의 항상성의 지표로서 위 상피 세포의 소멸을 살펴보기 위해 TUNEL 실험을 통해 추가적으로 실험을 진행하였다 (25). PBS 대조군과 비교했을 때, LipoLLA을 투여 받은 쥐들의 TUNEL 착색(staning)을 통해 특이할 만한 상피조직의 소멸은 보이지 않았다 (그림5D and E). 5일 동안 특이할 만한 위 상피 조직의 변화나 독성이 없다는 것은 LipoLLA의 경구투여가 안전하다는 것을 보여준다.
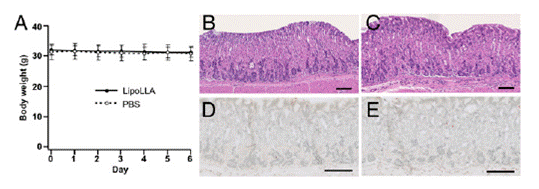
[그림 5. LipoLLA in vivo toxicity. Uninfected mice were orally administered
PBS buffer or LipoLLA once daily for 5 consecutive days. (A) MiceadministeredLipoLLA maintained the same body weight, similar to mice administeredPBS. All mice showed no obvious weight changes. (B?E) On day 6, micewere killed and sections of the mouse stomach processed and stained withhematoxylin and eosin (B and C) or TUNEL (D and E). LipoLLA treatment (Cand E) showed the same level of safety as PBS (B and D). (Scale bars, 100 μm.)]
LipoLLA는 흔한 식물성 기름에 들어있는 천연성분으로 만들어져 값도 싸고 독성도 없기 때문에 헬리코박터 파일로리균 (H. Pylori) 치료에 쓰이는 항생제를 효과적으로 대체할 수 있을 것이다.
[참고문헌]
1] In vivo treatment of Helicobacter pylori infection with liposomallinolenic acid reduces colonization and ameliorates inflammation. SorachaThamphiwatana, WeiweiGao, Marygorret Obonyo, and Liangfang Zhang
Edited by Robert Langer, Massachusetts Institute of Technology, Cambridge, MA, and approved October 24, 2014 www.pnas.org/cgi/doi/10.1073/pnas.1418230111