등록일2014-09-25
US FDA 항암 면역 치료제 PD-1 항체 승인
지난 25년 동안 이루어진 Oncogene에 대한 발견들은 표적 항암제 개발 시대를 열었다. 수많은 표적 항암제들이 개발되었고 환자들의 삶의 질과 생존율 향상에 도움을 주고 있으나, 암세포의 다양한 변이와 내성 문제로 인해 새로운 치료법들이 계속 개발되어야 하는 실정이다. 이러한 상황 속에서 사람의 면역체계가 암세포를 보다 잘 공격할 수 있도록 해주는 항암 면역 요법이 다시 주목 받고 있다. 2010년 US FDA를 통해 승인된 항체 신약 Yervoy (Ipilimumab, BMS 개발)는 면역 세포들의 면역 관문(Checkpoint) 중 CTLA-4를 억제하여 T 세포의 암세포 억제 작용을 강화하는 사실상 최초의 항암 면역 치료 항체라고 할 수 있다. 그로부터 4년이 지난 2014년에 이르러 Programmed Cell Death 1 (PD-1)과 T 세포간의 상호 작용을 억제하여 T 세포의 암세포 억제 작용을 증폭시키는 또 다른 항암 면역 치료 항체인 Keytruda (Pembrolizumab, Merck 개발)가 2014년 9월 US FDA를 통해 신속 승인(Accelerated approval)을 받게 되어 미국 내 환자들에게 먼저 사용될 수 있게 되었다.
그림1 . Keytruda (Pembrolizumab) 제품 사진
암세포가 면역 세포의 공격을 회피하는 방법
원래 사람의 면역 체계는 정상 세포의 성질을 잃고 급속하게 증식하는 암세포와 같은 변형된 세포를 인지하고 공격하는 면역 시스템을 지니고 있다. 수 많은 항암 연구자들은 어떻게 암세포가 이러한 우리 면역 시스템의 방어벽을 회피하는지에 대해 의문점을 가지고 있었다. 항암 연구자들은 다양한 연구들을 통해 암세포가 T 세포의 면역 기능을 억제하는 리간드를 과도하게 발현한다는 사실을 밝혀냈으며, 이러한 T 세포를 억제하는 과정을 면역 관문(Immune Checkpoints)라고 명명하였다. 이러한 면역 관문 중에 대표적인 예가 바로 PD-1 / PD-L1이다.
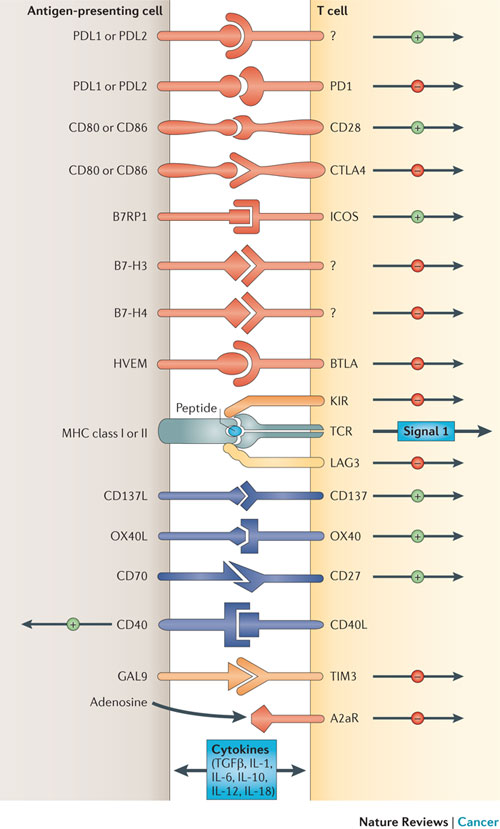
그림2 . 다양한 Immune Checkpoints가 존재하며, 다양한 항암 면역 요법이 개발되고 있다.
PD-1 / PD-L1을 저해하면 T 세포가 활성화되어 암세포를 억제
이러한 면역 관문에 대한 발견은 암세포가 T 세포의 공격을 회피하는 기전에 대한 힌트를 제공하였다. 연구자들은 이러한 사실을 바탕으로 T 세포를 불활성화 시키는 특정 표적 단백질을 차단함으로써, T 세포를 활성화하여 암세포를 잘 인식하고 보다 강력하게 억제할 수 있도록 하는 치료방법을 고안하게 되었다. 가장 대표적인 예가 바로 PD-1 / PD-L1을 저해하여 T 세포를 활성화 시키는 것이다. PD-1 / PD-1L 를 억제하는 치료제로 가장 빠르게 개발된 것이 단클론항체를 이용한 개발적 접근이었으며, 그 결과 PD-1을 억제하는 단클론항체가 가장 먼저 신약 승인을 받게 된 것이다.
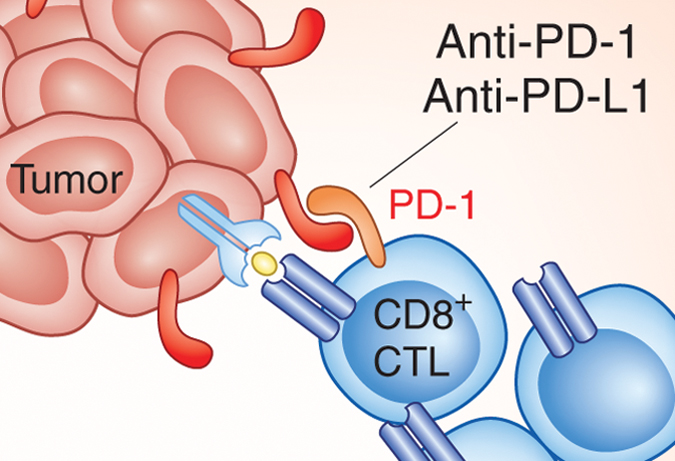
그림3. 암세포는 PD-1L을 과다 발현하고, 이것이 T 세포의 PD-1 수용체와 결합할 경우 T 세포는 불활성화되어 암세포를 공격하지 못하게 된다.PD-1 / PD-L1 항체는 이러한 T 세포의 불활성화를 막고, T 세포를 활성화하여 T 세포가 암세포를 공격할 수 있도록 도와준다.
가장 먼저 승인된 적응증은 흑색종(Melanoma) 치료
CTLA-4 항체인 Yervoy의 첫번째 항암 적응증이 피부암의 일종인 Melanoma였던것과 마찬가지로 PD-1항체의 경우에도 신약 허가를 가장 먼저 받은 적응증 역시 흑색종이다. 이번에 US FDA로부터 신약 허가를 받은 Keytruda (Pembrolizumab)의 경우 1) 수술적 절제가 불가능한 흑색종, 2) 전이성 흑색종이면서 Ipilimumab과 Braf Inhibitor 치료에 반응이 없는 흑색종에 대해서 먼저 신속 승인을 받게 되었다. US FDA에 등록된 제품의 Label 에 기재된 임상 시험 결과와 안전성 정보는 아래와 같다.
1. 임상 시험 결과 : Efficacy
총 173명의 말기 흑색종 환자 (수술적 절제가 불가능하거나, 기존 치료제(Ipilimumab, Braf inhibitor)에 불응하는 환자)를 대상으로 Keytruda 3주 1회 투약하였다. Overall Response Rate 는 약 24% (95% CI : 15, 34)였으며, 이 때 1명의 경우 Complete Response, 20명은 Partial Response를 보였다. 아직 Overall Survival에 대한 최종 결과는 수집되지 않았으나, 치료 1년 후 까지의 생존율은 약 69%로 보고되었다.
2. 임상 시험 결과 : Safety
내약성은 대체적으로 우수한 편이나, 아래와 같은 자가면역작용 증가에 따른 부작용들이 보고 되고 있다
Immune-Mediated Pneumonitis (2.9%), Immune-Mediated Colitis (1.0%), Immune-Mediated Hepatitis (0.5%), Immune-Mediated Hypophysitis (0.5%) 등
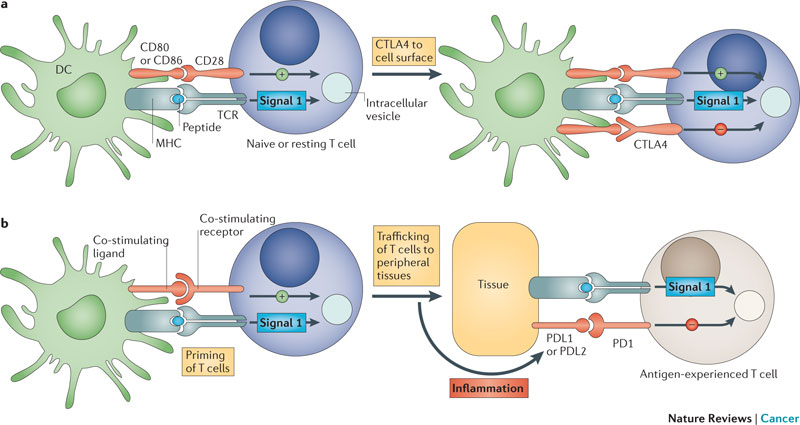
그림4. CTLA4 항체와 PD-1/PD-L1 항체의 작용 기작에 대한 설명
폐암, 신장암, 방광암 등에 대한 다양한 임상들이 진행 중이며, 적응증은 확대될 전망
US FDA의 신속 승인 제도를 통해 허가된 1차 적응증은 말기 흑색종이지만, 실제 PD-1 / PD-L1 항체 제품들은 다양한 암종에 대한 임상들이 진행 중이며, 곧 적응증을 확대할 것으로 기대되고 있다.
현재 진행 중인 임상들 중에서 가장 주목 받는 부분은 역시 Non-small cell lung cancer, renal cell cancer, melanoma, bladder cancer인 것으로 보여진다.

표1. 현재 진행 중인 주요 PD-1 / PD-L1 항체 제품의 임상 진행 목록
PD-1 / PD-L1 항체가 모든 종류의 암종에 효과가 있을 것이라고 기대할 수는 없지만, 기존의 표적 항암제에 비해서는 보다 넓은 범위의 암종들에 효과가 있으리라고 예측되고 있어, 현재 진행중인 다양한 암종에서의 임상 실험에서 좋은 결과가 도출될 경우, 보다 많은 암환자들에게 치료의 혜택이 돌아갈 수 있을 것으로 기대된다.
국내 출시는 언제……
1차 적응증인 흑색종(Melanoma)의 환자들이 가장 많은 미국에서는 Merck의 Keytruda의 승인이 2014년 9월 이루어졌으나, 아시아 지역에서는 BMS의 Opdiva (Nivolumab)이 2014년 7월 전세계 최초로 일본의 노동 후생성으로부터 신약 승인을 받았다.
한국의 경우 Opdiva(Nivolumab)의 한국 판권을 지닌 일본제약사인 ONO Pharmaceutical이 한국 내 신약 허가를 진행할 것으로 보인다. 되도록 빠른 허가가 진행되어 한국의 암환자들도 PD-1 항체 신약을 투여 받을 수 있기를 기대해 본다.
[근거문헌]
US FDA Drug Information, KEYTRUDA (Pembrolizumab, Merck#amp;Co., Inc), 2014
Drew M. Pardoll, The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer 12, 252-264 (2012)
Elad Sharon et al., Immune Checkpoint inhibitors in clinical trials. Chin J Cancer; 2014; Vol.33 Issue 9