등록일2014-02-26
기저 세포 암 치료제로써 항진균제인 이트라코나졸의 효과
1. 연구배경
기저 세포암(basal cell carcinoma, BCC)은 피부암 중 가장 흔한 암으로 백인에게서 발병율이 높다고 알려져 있고 주변 조직에 침입 하여 주변 조직을 파괴 및 손상을 일으킬 수 있어 악성종양으로 간주하고 있다.
발병 주요 원인은 자외선에 노출과 방사선 노출, 면역 기능 저하 등에 있고 basal cell nerve syndrome 혹은 gorlin syndrome 이라고 하는 유전적 원인에 있다고 알려져 있다.
치료법으로는 초기절제술로 관리 할 수 있고 저온수술과 전기 수술 등의 치료법이 있다. 비수술적 방법으로는 imiquimod와 5-Fluorouracil 연고의 치료 방법이 있지만 치료범위가 국소적이므로 모든 암 조직을 제거하지는 못하는 단점이 있다.
현재 밝혀진 암 발생 경로로는 활성화되어 있는 Hedgehog (HH) signaling pathway 가 주요 원인으로 알려져 있다. HH 경로는 배아기 동안 세포의 성장과 분화를 조절하는 역할을 하며 성인이 되어서는 거의 활성화 되지 않는다. 하지만 이 경로의 비정상적인 활성이 BCC와 수모 세포종(medulloblastoma)과 같은 암의 발생에 중요한 역할을 한다고 알려져 있다. HH 리간드가 없는 불활성화 상태에서는 세포표면에 위치한 transmembrane protein인 Patched(PTCH)가 Smootherned(SMO)의 활성을 억제하여 HH 신호경로의 활성을 억제하고 HH 리간드가 PTCH1에 결합하면 SMO가 활성화되어 세포성장을 조절하는데 영향을 미치는 표적유전자를 유도한다.
기저 세포 모반 증후군 환자에서는 종양 억제 유전자인 PTCH1의 돌연변이가 발생하며 PTCH1 단백질의 억제기능이 상실되어서 SMO가 활성화된다. 유전성 암증후군에서 와는 달리, 산발적으로 발생하는 BCC 환자에서 PTCH1의 돌연변이는 65-70%까지 발견되며, SMO의 돌연변이 때문에 PTCH1의 억제에 저항하여 HH 신호경로가 활성화 되는 것은 10% 정도로 관찰된다.
그러므로 HH 신호 경로를 차단하는 약물을 사용하여 BCC의 치료 방법으로 접근하려는 시도들이 진행되고 있다.
본 연구는 HH 경로에 대한 길항제로써 역할을 하는 항진균제인 이트라코나졸에 대한
BCC 종양 억제 효과를 확인하기 위해 산발적 BCC 환자를 대상으로 한 임상적 연구
결과를 발표하였다.
The HH pathway critical components which could be targeted by potential antibasal cell carcinoma drugs.
Notes: The mechanism of action of each single drug is explained in the text. The question mark indicates a so far undetermined mechanism. The EGFR and PI3K pathways are also sketched, given their potential contribution to Hh pathway tumorigenic activity.
Abbreviations: Ac, acetyl group; Ch, cholesterol; EGFR, epidermal growth factor receptor; ERK, extracellular signal-related kinase; GANT, Gli antagonist; Hdac, histone deacetylase; Hh, Hedgehog; HPI, Hedgehog pathway inhibitor; KCASH, KCTD (Potassium Channel Tetramerization Domain) containing cullin3 adaptor suppressor of hedgehog; MEK, mitogen-activated protein kinase kinase; P, palmitate; PI3K, phosphatidylinositol 3-kinase; PKB/akt, protein kinase B; Ptch, Patched; Quinaz, quinazolines; Robotk, robotnikinin; Smo, Smoothened; SuFu, suppressor of fused; TSA, trichostatin A; VitD3, Vitamine D3.
2. 연구방법
BCC 종양의 크기가 4 mm 이상이고 간기능에 문제가 없는 환자를 대상으로 하였으며 BCC 종양에 또는 이트라코나졸의 대사(예, 항 경련제, 부신 피질 호르몬)에 영향을 줄 수 있는 약물을 복용하지 않는 환자를 대상으로 하였다. 코호트 연구 A 대상자는 이트라코나졸 200 mg을 하루에 두 번 복용하게 한 환자를 대상으로 종양 증식 인자인 Ki67 정도와 HH 경로의 활성도, 종양의 크기 변화에 대한 효과를 확인하였고 코호트 연구 B 대상자는 100 mg 을 하루에 두 번 복용하게 하여 평균 2-3개월 간의 낮은 용량의 이트라코나졸에 대한 장기적인 임상적인 효과를 확인하였다.
3. 결과
1. 환자의 통계적 특성
대조군과 이트라코나졸 치료군의 베이스라인은 아래의 표와 같이 연령과 성별, BCC type, BCC 종양의 위치가 비슷함을 확인하였고 종양 발병 위치는 신체 중 햇빛에 노출되는 얼굴과 목에 많이 발병한 것을 확인할 수 있다.
2. 약물에 의한 가역적 변화
19명 중 2명에 대해 이트라코나졸 약물에 대한 가역적 반응으로 치료를 중지했다. 1명이 충혈성 심부전이 관찰되었지만 이것은 림포마에 대해 초기의 adriamycin 치료에서 온 심장 질환을 갖은 환자에서 발병한 것이고 다른 한 명은 피로함 증상 때문에 중지했지만 그 외 다른 가역적 부작용은 크지 않았다. 또한 약물 치료기간 동안 간기능 테스트에서 AST/ALT가 증가는 없었다.
3. 바이오마커 분석(코호트 A 연구)
베이스라인에서와 약물 투여 후 절제술에서 얻은 조직에서 Ki67을 염색한 결과
이트라코나졸 치료군 환자의 경우 치료 후 종양 증식 표지 인자 정도가 35%까지 감소
하였다. 이로써 이트라코라졸의 종양 감소 효과를 확인했고(그림 2A), 그림 2B에서와
같이 정상군에서는 절제시 얻은 조직에서는 종양 증식 인자가 증가한 반면 이트라코나
졸 치료군은 베이스라인에 비해 종양 증식 인자가 감소함을 확인하였다.
베이스라인에서와 절제시점에서의 종양 증식 인자를 비교하면 이트라코나졸은
vismodegib 치료 경험이 없는 환자에서 45%까지 종양 증식 인자를 감소시켰다(그림2D).
그리고 HH 신호 경로에 관한 인자인 GLI1 정도 역시 감소시켰다(그림 3).
Fig 2.Ki67 quantification and analysis ofbasal cell carcinoma (BCC) tumors. (A)Unpaired analysis of individual tumorsfrom control patients and itraconazoletreatedpatients. Ki67 staining of BCC tumorsat baseline and excision from (B)control patients and (C) vismodegib-naivepatients treated with itraconazole. Positive(brown) staining indicates proliferatingnuclei; negative (blue) staining indicatesno proliferative activity. Paired analysis ofpatient Ki67 averages among (D) vismodegibnaivepatients and (E) control patientstreated with itraconazole.
Fig 3.Levels of GLI1 mRNA expressionin basal cell carcinoma tumors from patientstreated with itraconazole for 1 month.Some patients had previously receivedtreatment with vismodegib and were nolonger responsive to vismodegib. (A) Unpairedanalysis of GLI1 mRNA levels fromtumors at baseline and excised tumors afteritraconazole treatment. As control, GLI1mRNA was assessed in normal nontumorskin. GLI1 mRNA decreased by 65% invismodegib-naive patients treated with itraconazolefrom baseline to excision (P _.028). (B) In paired analysis of tumors fromsame patients, itraconazole decreased GLI1expression by 45% after 1 month invismodegib-naive patients only.
4. 종양 크기와 임상학적 반응
이트라코나졸은vismodegib 치료 경험이 없는 환자 29 명중 8명의 종양에서 종양 크기를 줄였고 피부 손상의 재상피화가 개선되었다. (그림4).
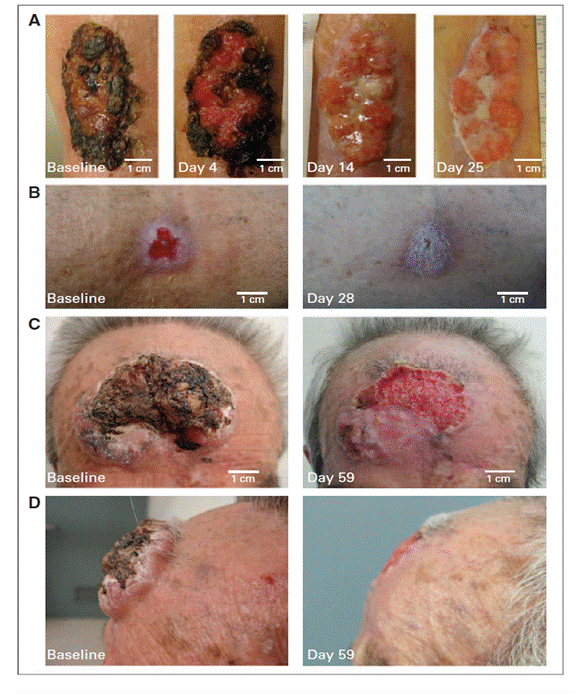
두 코호트 연구에서 이트라코나졸 치료 후 종양 면적에서의 변화는 그림 5에 보이는
것과 같이vismodegib 에 대한 치료가 없었던 환자에서 24%까지 감소시켰다. 또한
종양의 감소 효과는 코호트 연구B 와 A군이 비슷하여 이트라코나졸의 낮은 농도로의
장기 치료 또한 임상학적으로 현저한 종양 억제 효과가 나타남을 확인했다.
이트라코나졸은 치료 한 달째에 HH 시그널 경로를 차단하면서 BCC 종양 크기를
감소시키는 것을 확인하여 치료법이 제한적인 BCC에 치료방법으로 제안될 수 있음을
시사하였다.
이트라코나졸은cyclopamine과vismodegib과는 다르게 작용하는 때문에 부가적인 치료
방법으로써 효과적이지만 이 연구자들은 이트라코나졸 혹은 cyclopamine 단독 보다는
SMO을 타겟하는 약물과의 병용 치료가 종양 억제 효과가 더 효과적일 수 있음을
제안하였다. 최근 arsenic trioxide (ATO) 와 이트라코나졸의 병용치료가 BCC와
vismodegib에 내성이 있는 medullobloastoma에 대한 치료 효과가 보고되었다. ATO는
HH 길항제로써 SMO 의 하위 인자인 GLI2를 불안정화시키는 역할을 하므로
이트라코나졸과 ATO의 병용치료가BCC 종양에 효과적일 수 있음을 제안하면서
vismodegib 치료 효과에 실패한 전이성 BCC 환자에 두 약물의 병용 효과에 대한
임상학적 연구를 진행하고 있다.
BCC에 대해서 이트라코라졸을 새로운 치료방법으로 확대하는 것은 효과적인 방안이 될
수 있지만 짧은 기간 치료 효과에 대해 접근했기 때문에 기존 치료제인vismodegib과
이트라코나졸과의 장시간 치료 효과에 대한 비교 연구가 필요하다. 또한 이트라코나졸의
효과는 용량의존적인 것으로 보고되어 있어 고용량으로 장기간 치료 시 독성과 종양
억제 효과에 대한 추가적인 연구가 이루어져야 한다.
참고문헌
1. J ClinOncol. 2014: 3 [Epub ahead of print]
2. J ExpPharmacol. 2012:4 173?185
3. Cancer Cell. 2010:17(4)388-99